RECUENTO DE AEROBIOS MESOFILOS POR FILTRACIÓN
OBJETIVOS: sembrar y contar las unidades formadoras de colonias que hay en un filtro.
FUNDAMENTO: Los coliformes resisten la presencia de bilis en el medio de cultivo; cuando se desarrollan en ABRV, el ácido producido por la fermentación de la lactosa, ocasiona el vire del indicador rojo neutro y la precipitación de las sales biliares por lo que las colonias son color rojo oscuro y generalmente están rodeadas de un halo de sales biliares precipitadas, de color rojo claro o rosa. La posibilidad de contar las colonias se fundamenta en su dispersión y separación
MATERIALES Y REACTIVOS:Vaso de precipitado x2 (agua muestra, alcohol), Embudo, Probeta, Pipeta Pasteur, Matraz Kitasato, Alcohol,Placa Petri estéril,Pinzas, Mechero Bunsen, Mechero,Filtro reticulado
PROCEDIMIENTOS: Cogemos 100 ml de agua de muestra, vertimos y enrasamos en la probeta con la pipeta Pasteur.
Ahora filtramos al vacío el agua de muestra.
(Preparación para la filtración al vacío con el Kitasato): Preparamos la bomba de vacío, matraz Kitasato y mechero Bunsen (mismo procedimiento para las filtraciones). Echamos un poco de alcohol en un vaso de precipitado, agua destilada estéril en una placa Petri estéril y encendemos el mechero. Mojamos las pinzas en alcohol y flameamos rápidamente en el mechero Bunsen. Tomamos el filtro y lo metemos en agua destilada estéril, retirando el papel de filtro reticulado y colocándolo sobre el matraz. Flameamos las pinzas de nuevo y procedemos a verter la mezcla sobre el embudo del matraz y encendemos la bomba de vacío. Una vez filtrado, volvemos a flamear las pinzas y tomamos el filtro reticulado, colocándolo, con cuidado de no dejar burbujas, sobre el medio ENDO
Ponemos fecha y nombre de práctica en la placa para identificarla, y metemos en el horno a 40ºC.
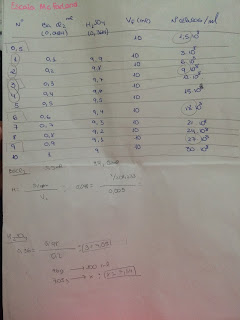
CALCULOS Y RESULTADOS: UFC/ml: no importa porque salió menos de 30.